
Капли датского короля
Капли датского короля.
Российская военная фармакопея, 1913 год.


Наше предприятие осуществляет заготовку, сушку и реализацию пряно-ароматического и лекарственного…
Европейская Фармакопея издание 7.0 часть 1 2010 год (Ph. Eur. 7.0) стр. 1117-1118. Бузины цветки
01/2008:1217 исправлено 6.0
БУЗИНЫЦВЕТКИ
Sambuci flos
ОПРЕДЕЛЕНИЕ
Высушенные цветки вида Sambucus nigra L.
Содержание: минимум 0,80% флавоноидов, в пересчёте на изокверцитрозид (C21H20O12; Mr 464.4) (сухое сырьё).
ИДЕНТИФИКАЦИЯ
A. Цветок диаметром около 5 мм, имеет 3 небольших прицветника (видны под лупой) и может иметь цветонос. Пятизубчатая чашечка маленькая; венчик светло-жёлтый, имеет 5 широко овальных лепестков, сросшихся у основания в трубку. Нити 5 жёлтых тычинок чередуются с лепестками. Венчик часто отдельный или он прикреплён к тычинкам, с которыми сросся у основания. Завязь разделена на три гнезда, от неё отходит короткий столбик с тремя тупыми рыльцами.
B. Растереть в порошок (355) (2.9.12). Порошокзеленовато-жёлтый. Исследовать под микроскопом, используя раствор хлоралгидрата Р. Порошок демонстрирует следующие диагностические признаки: множество сферических, иногда эллипсоидных пыльцевых зёрен около 30 мкм в диаметре, с тремя зародышевыми порами и очень мелкоячеистой экзиной; клетки эпидермиса чашечки с борозчатой кутикулой и, иногда, с одноклеточными зубцами, отходящими от края; фрагменты венчика с многочисленными мелкими шариками эфирного масла, они же в верхнем эпидермисе слегка крупнее и бисерно покрывают стенки и борозчатую кутикулу; клетки мезофилла лепестков и чашелистиков с идиобластами, содержащими песковидные кристаллы кальция.
C. Исследуйте хроматограмму, полученную в испытании на Sambucus ebulus.
Обнаружение : в ультрафиолетовом свете при 365 нм.
Результаты: на хроматограмме испытуемого раствора интенсивное светло-голубое флуоресцентное пятно, соответствующее хлорогеновой кислоте, оранжевое флуоресцентное пятно, соответствующее рутину, а также оранжевое флуоресцентное пятно, соответствующее изоквертицину, которые появляются чуть выше пятна гиперозида на хроматограмме раствора сравнения. Зеленовато-голубое пятно на хроматограмме испытуемого раствора немного выше пятна кофеиновой кислоты на хроматограмме раствора сравнения. Могут присутствовать дополнительные слабо флуоресцентные пятна. На хроматограмме испытуемого раствора в дневном свете чётко видны только оранжевые пятна рутина и изоквертицина.
ИСПЫТАНИЯ
Посторонние вещества (2.8.2). максимум 8% грубых стебельков и других потсоронних веществ и максимум 15% обесцвеченных, коричневых цветков. Проводить определение на 10 г.
Sambucus ebulus L. Тонкослойная хроматография (2.2.27).
Испытуемый раствор. К 0,5 г измельчённого сырья (355) (2.9.12) добавить 10 мл метанола Р и нагревать на водяной бане при 65 °C в течение 5 минут, часто встряхивая. Дать остыть и отфильтровать. Разбавить фильтрат до 10 мл метанолом Р.
Раствор сравнения. Растворить 1 мгкофеиновой кислоты Р, 1 мг хлорогеновой кислоты Р, 2,5 мг гиперозида Р и 2,5 мг рутина Р в 10 мл метанола Р.
Пластинка: силикагельная пластинка для хроматографии Р.
Подвижная фаза: безводная муравьиная кислота Р, вода Р, метилэтилкетон Р, этилацетат Р (10:10:30:50 об/об/об).
Объём пробы: 10 мкл в виде полос.
Фронт подвижной фазы: не менее 15 см.
Высушивание: при 100-105 °C.
Обнаружение: обрызгать горячую пластину 10 г/л раствором аминэтилового эфира дифенилборной кислоты Р в метаноле Р; затем обрызгать 50 г/л раствором макрогола 400 Р в метаноле Р. Дать высохнуть на воздухе в течение 30 минут и изучить в ультрафиолетовом свете при 365 нм.
Результаты: на хроматограмме раствора сравнения в нижней половине в порядке возрастания RF оранжевое флуоресцентное пятно рутина, светло-голубое флуоресцентное пятно хлорогеновой кислоты и оранжево-жёлтое или оранжево-коричневое флуорересцентное пятно гиперозида. В верхней трети присутствует зеленовато-голубое флуоресцентное пятно кофеиновой кислоты. На хроматограмме испытуемого раствора не должно розового пятна ниже пятна рутина на хроматограмме раствора сравнения.
Потеря при высушивании (2.2.32): максимум 10,0%, определять на 1,000 г измельчённого сырья (355) (2.9.12) высушиванием в сушильном шкафу при 105 °C в течение 2 часов.
Общая зола (2.4.16): максимум 10,0%.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ
Исходный раствор. В 100-миллилитровую круглодонную колбу поместить 0,600 г измельчённого сырья (355) (2.9.12), добавить 1 мл 5 г/л раствора гексаметилентетрамина Р, 20 мл ацетона Р и 2 мл хлороводородной кислоты Р1. Кипятить смесь с обратным холодильником в течение 30 минут. Отфильтровать через ватный тампон в колбу. Поместить ватный тампон в к остатку в круглодонной колбе и экстрагировать двумя порциями, по 20 мл каждая, ацетона Р, каждый раз кипятя с обратным холодильником по 10 минут. Дать остыть, отфильтровать каждый экстракт через ватный тампон. После охлаждения отфильтровать ацетоновые экстракты через бумажный фильтр в мерную колбу, довести до 100,0 мл ацетоном Р, споласкивая колбу и бумажный фильтр. Поместить 20,0 мл этого раствора в делительную воронку, добавить 20 мл воды Р и встряхивать смесь с одной порцией в 15 мл, а затем с тремя порциями по 10 мл этилацетата Р. Объединить ацетатные вытяжки в делительной воронке, промыть двумя порциями по 50 мл воды Р, отфильтровать экстракт через 10 г безводного сульфата натрия Р в мерную колбу до 50,0 мл этилацетатом Р.
Испытуемый раствор. К 10,0 мл исходного раствора добавить 1 мл реактива алюминия хлорида Р и довести до 25,0 мл 5%-м об/об раствором ледяной уксусной кислоты Р в метаноле Р.
Раствор сравнения. Довести 10,0 мл исходного раствора до 25,0 мл 5%-м об/об раствором ледяной уксусной кислоты Р в метаноле Р.
Через 30 минут измерить оптическую плотность (2.2.25) испытуемого раствора при 425 нм относительно раствора сравнения.
Рассчитать процентное содержание флавоноидов в пересчёте на изокверцитрозид, используя следующее выражение:
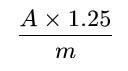
т.е. взяв удельный показатель поглощения изокверцитрозида равный 500.
A = поглощениепри 425 нм,
m = масса образца, г.
01/2008:1217 corrected 6.0 DEFINITION Detection: in ultraviolet light at 365 nm. Foreign matter (2.8.2). maximum 8 per cent of fragments of coarse pedicels and other foreign matter and maximum 15 per cent of discoloured, brown flowers. Carry out the determination on 10 g. Stock solution. In a 100 mL round-bottomed flask, introduce 0.600 g of the powdered drug (355) (2.9.12), add 1 mL of a 5 g/L solution of hexamethylenetetramine R, 20 mL of acetone R and 2 mL of hydrochloric acid R1. Boil the mixture under a reflux condenser for 30 min. Filter the mixture through a plug of absorbent cotton into a flask. Add the absorbent cotton to the residue in the round-bottomed flask and extract with 2 quantities, each of 20 mL, of acetone R, each time boiling under a reflux condenser for 10 min. Allow to cool, filter each extract through the plug of absorbent cotton into the flask. After cooling, filter the combined acetone extracts through a filter paper into a volumetric flask, dilute to 100.0 mL with acetone R by rinsing the flask and the filter paper. Introduce 20.0 mL of this solution into a separating funnel, add 20 mL of water R and shake the mixture with 1 quantity of 15 mL and then 3 quantities, each of 10 mL, of ethyl acetate R. Combine the ethyl acetate extracts in a separating funnel, wash with 2 quantities, each of 50 mL, of water R, and filter the extracts over 10 g of anhydrous sodium sulfate R into a volumetric flask and dilute to 50.0 mL with ethyl acetate R.
ELDER FLOWER
Sambuci flos
Dried flowers of Sambucus nigra L.
Content: minimum 0.80 per cent of flavonoids, expressed as isoquercitroside (C21H20O12; Mr 464.4) (dried drug).
IDENTIFICATION
A. The flower, about 5 mm in diameter, has 3 small bracts (hand lens) and may have a peduncle. The 5-toothed calyx is small; the corolla is light yellow, with 5 broadly oval petals fused at their bases into a tube. The filaments of the 5 yellow stamens alternate with the petals. The corolla is often isolated or attached to the stamens, to which it is fused at the base. The ovary is inferior with 3 locules and it bears a short style with 3 obtuse stigmata.
B. Reduce to a powder (355) (2.9.12). The powder is greenish-yellow. Examine under a microscope using chloral hydrate solution R. The powder shows the following diagnostic characters: numerous spherical, sometimes ellipsoidal, pollen grains about 30 pm in diameter, with 3 germinal pores and very finely pitted exine ; calyx epidermal cells with a striated cuticle and occasional unicellular marginal teeth from the basal region; corolla fragments with numerous small globules of volatile oil, those of the upper epidermis with slightly thickened and beaded walls and a striated cuticle ; mesophyll cells of petals and sepals with idioblasts containing numerous sandy crystals of calcium oxalate.
C. Examine the chromatograms obtained in the test for Sambucus ebulus.
Results: the chromatogram obtained with the test solution shows an intense light blue fluorescent zone due to chlorogenic acid, an orange fluorescent zone due to rutin as well as an orange fluorescent zone due to isoquercitrin, which appears slightly above the zone due to hyperoside in the chromatogram obtained with the reference solution. A greenish-blue fluorescent zone appears in the chromatogram obtained with the test solution a little below the caffeic acid zone in the chromatogram obtained with the reference solution. Additional faint fluorescent zones may be present. In daylight, only the orange fluorescent zones due to rutin and isoquercitroside in the chromatogram obtained with the test solution are clearly visible.
TESTS
Sambucus ebulus L. Thin-layer chromatography (2.2.27).
Test solution. To 0.5 g of the powdered drug (355) (2.9.12) add 10 mL of methanol R and heat in a water bath at 65 °C for 5 min, shaking frequently. Allow to cool and filter. Dilute the filtrate to 10 mL with methanol R.
Reference solution. Dissolve 1 mg of caffeic acid R, 1 mg of chlorogenic acid R, 2.5 mg of hyperoside R and 2.5 mg of rutin R in 10 mL of methanol R.
Plate: TLC silica gel plate R.
Mobile phase: anhydrous formic acid R, water R, methyl ethyl ketone R, ethyl acetate R (10:10:30:50 V/V/V).
Application: 10 μL, as bands.
Development: over a path of 15 cm.
Drying: at 100-105 °C.
Detection: spray the plate whilst hot with a 10 g/L solution of diphenylboric acid aminoethyl ester R in methanol R; subsequently spray with a 50 g/L solution of macrogol 400 R in methanol R. Allow to dry in air for 30 min and examine in ultraviolet light at 365 nm.
Results: the chromatogram obtained with the reference solution shows in the lower half, with increasing RF values, the orange fluorescent zone due to rutin, the light blue fluorescent zone due to chlorogenic acid and the orange-yellow or orange-brown fluorescent zone due to hyperoside. The upper third presents a greenish-blue fluorescent zone due to caffeic acid. The chromatogram obtained with the test solution does not show a pink zone below the zone due to rutin in the chromatogram obtained with the reference solution.
Loss on drying (2.2.32): maximum 10.0 per cent, determined on 1.000 g of the powdered drug (355) (2.9.12) by drying in an oven at 105 °C for 2 h.
Total ash (2.4.16): maximum 10.0 per cent.
ASSAY
Test solution. To 10.0 mL of the stock solution add 1 mL of aluminium chloride reagent R and dilute to 25.0 mL with a 5 per cent V/V solution of glacial acetic acid R in methanol R.
Compensation liquid. Dilute 10.0 mL of the stock solution to 25.0 mL with a 5 per cent V/V solution of glacial acetic acid R in methanol R.
After 30 min, measure the absorbance (2.2.25) of the test solution at 425 nm, by comparison with the compensation liquid.
Calculate the percentage content of flavonoids, expressed as isoquercitroside, using the following expression: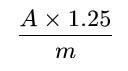
i.e. taking the specific absorbance of isoquercitroside to be 500.
A = absorbance at 425 nm,
m = mass of the drug to be examined, in grams.