
Капли датского короля
Капли датского короля.
Российская военная фармакопея, 1913 год.


Наше предприятие осуществляет заготовку, сушку и реализацию пряно-ароматического и лекарственного…
Европейская Фармакопея издание 7.0 часть 1 2010 год (Ph. Eur. 7.0) стр. 1115-1116. Шиповника плоды
01/2008:1510 corrected 6.0
DOG ROSE
Rosae pseudo-fructus
ОПРЕДЕЛЕНИЕ
Плоды шиповника, состоящие из цветоложа и остатков высушенных чашелистиков шиповника Rosa canina L., R. pendulina L. и других видов шиповника с удалёнными семенами.
Состав: минимум 3% аскорбиновой кислоты (C6H8O6; Mr 176.1) (в сухом сырьё).
ИДЕНТИФИКАЦИЯ
A. Сырьё состоит из фрагментов мясистых полых кувшинчатых цветолож, имеющих на себе остатки чашелистиков, светло-розовых или оранжево-розовых, выпуклая внешняя поверхность блестящая и сильно морщинистая; более светлая внутренняя поверхность покрыта как щетиной множественными волосками.
B. Растереть в порошок (355) (2.9.12). Порошок оранжево-жёлтого цвета. Изучить порошок под микроскопом, используя раствор хлоралгидрата Р. У порошка следующие диагностические признаки: многочисленные фрагменты цветолож, верхний эпидермис имеет оранжево-жёлтое содержимое и тонкую кутикулу, нижний эпидермис состоит из тонкостенных клеток, включающих в себя кластеры кристаллов и иногда отдельные призмы оксалата кальция; рассеянные одревесневшие клетки, изодиаметрические, с утолщёнными изрытыми стенками, образующими основания трихом, многочисленные одноклеточные трихомы до 2 мм длинной и 30-45 нм шириной, сужающиеся в направлении каждого конца, с сильно утолщёнными стенками, покрытые восковой кутикулой, на которой могут быть видны спиралевидные трещины; многочисленные маслянистые оранжево-жёлтые глобулы.
C. Тонкослойная хроматография (2.2.27).
Испытуемый раствор. К 5,0 г измельчённого сырья (355) (2.9.12)добавить 25 мл этанола(96%) Р. Встряхнуть в течение 30 минут и отфильтровать.
Раствор сравнения. Растворить 10 мг аскорбиновой кислоты Р в 5,0 мл этанола (60% об/об) Р.
Пластинка: ТХС пластинка со слоем силикагеля F254 Р.
Подвижная фаза: уксусная кислота Р, ацетон Р, метанол Р, толуол Р (5:5:20:70 об/об/об/об).
Объём пробы: 20 мкл испытуемого раствора и 2 мкл раствора сравнения.
Фронт подвижной фазы: не менее 15 см от старта.
Высушивание: на воздухе.
Проявление A: изучить в ультрафиолете при 254 нм.
Результаты A: на хроматограмме, полученной для испытуемого раствора, видны приглушённые пятна в тех же положениях, как у основных пятен на хроматограмме раствора сравнения.
ПроявлениеB: орбрызгать пластинку раствором 0,2 г/л дихлорфенолиндофенола натриевой соли Р в этаноле (96%) Р. Изучить в дневном свете.
Результаты B: на хроматограмме испытуемого раствора наблюдается белое пятно на розовом фоне в положении таком же как и у такого же по цвету пятна на хроматограмме испытуемого раствора. На хроматограмме также видно интенсивное оранжево-жёлтое пятно около фронта растворителя и жёлтое пятно в верхней трети пути подвижной фазы (каротиноиды).
ИСПЫТАНИЯ
Посторонние вещества (2.8.2): максимум 1%.
Потеря при высушивании (2.2.32): максимум 10,0%, определять на 1,000 г измельчённого сырья (355) (2.9.12) высушиванием в сушильном шкафу при 105 °C.
Общая зола (2.4.16): максимум 7,0%.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ
Испытуемый раствор. Поместить в круглодонную колбу 0,500 г свежеизмельчённого сырья (710) (2.9.12). Добавить раствор 1,0 г щавелевой кислоты Р в 50,0 мл метанола Р. Прокипятить с обратным холодильником в течение 10 минут, охладить в ледяной воде до температуры 15-20 °C. Отфильтровать. Поместить 2,0 мл фильтрата в 50-миллилитровую коническую колбу. Последовательно добавить при осторожном встряхивании после каждого добавления 2,0 мл дихлорфенолиндофенола стандартный раствор Р, затем строго через 60 секунд 0,5 мл раствор 100 г/л тиомочевины Р в этаноле (50% об/об) Р и 0,7 мл раствора динитрофенилгидразина в серной кислоте Р. Нагревать с обратным холодильником до 50 °Cв течение 75 минут, затем немедленно поместить в ледяную воду на 5 минут. Добавить по каплям 5,0 мл смеси из 12 мл воды Р и 50 мл серной кислоты Р, позаботившись о том, чтобы добавление происходило в течение минимум 90 и максимум 120 секунд при сильном перемешивании в ледяной воде. Дать постоять в течение 30 минут при комнатной температуре и измерить оптическую плотность (2.2.25) на длине волны 520 нм относительно раствора А.
Раствор А. Обработать 2,0 мл фильтрата, полученного при приготовлении испытуемого раствора, как описано выше, только раствор динитрофенилгидразина в серной кислоте Р добавть непосредственно перед измерением оптической плотности.
Раствор сравнения. Растворить 40,0 мг аскорбиновой кислоты Р в свежеприготовленном растворе 20 г/л щавелевой кислоты Р в метаноле Р и разбавить до 100,0 мл тем же растворителем. Развести 5,0 мл этого раствора свежеприготовленным раствором 20 г/л щавелевой кислоты Р в метаноле Р. Обработать 2 мл раствора как было описано выше для фильтрата при приготовлении испытуемого раствора. Измерить оптическую плотность (2.2.25) при 520 нм относительно раствора В.
Раствор B. Обработать 2,0 мл раствора сравнения как описано выше для раствора А.
Рассчитать процентное содержание аскорбиновой кислоты по следующему выражению: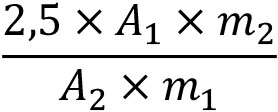
A1 = оптическая плотность испытуемого раствора;
A2 = оптическая плотность растора сравнения;
m1 = масса образца сырья, г;
m2 = масса аскорбиновой кислоты, г.
Европейская Фармакопея издание 7.0 часть 1 2010 год (Ph. Eur. 7.0) стр.
01/2008:1510 corrected 6.0
DOG ROSE
Rosae pseudo-fructus
DEFINITION
Rose hips made up by the receptacle and the remains of the dried sepals of Rosa canina L., R. pendulina L. and other Rosa species, with the achenes removed.
Content: minimum 0.3 per cent of ascorbic acid (C6H8O6; Mr 176.1) (dried drug).
IDENTIFICATION
A. It consists of fragments of the fleshy, hollow, urceolate receptacle, bearing the remains of the reduced sepals, light pink or orange-pink, the convex outer surface shiny and strongly wrinkled; bearing on its lighter inner surface abundant bristle-like hairs.
B. Reduce to a powder (355) (2.9.12). The powder is orange-yellow. Examine under a microscope using chloral hydrate solution R. The powder shows the following diagnostic characters: numerous fragments of receptacle, the outer epidermis with orange-yellow contents and a thick cuticle, the inner epidermis composed of thin-walled cells containing cluster crystals and occasional prisms of calcium oxalate ; scattered lignified cells, isodiametric, with thickened and pitted walls forming the trichome bases; abundant long, unicellar trichomes, up to 2 mm long and 30-45 pm thick, tapering towards each end, walls heavily thickened and with a waxy cuticle which may show fissures in a spiral arrangement; numerous oily orange-yellow globules.
C. Thin-layer chromatography (2.2.27).
Test solution. To 5 g of the powdered drug (355) (2.9.12) add 25 mL of ethanol (96 per cent) R. Shake for 30 min and filter.
Reference solution. Dissolve 10 mg of ascorbic acid R in 5.0 mL of ethanol (60 per cent V/V) R.
Plate: TLC silica gel F254 plate R.
Mobile phase: acetic acid R, acetone R, methanol R, toluene R (5:5:20:70 V/V/V/V).
Application: 20 μL of the test solution and 2 μL of the reference solution.
Development: over a path of 15 cm.
Drying: in air.
Detection A: examine in ultraviolet light at 254 nm.
Results A: the chromatogram obtained with the test solution shows a quenching zone similar in position to the principal zone in the chromatogram obtained with the reference solution.
Detection B: spray with a 0.2 g/L solution of dichlorophenolindophenol, sodium salt R in ethanol (96 per cent) R. Examine in daylight.
Results B: the chromatogram obtained with the test solution shows a white zone on a pink background similar in position and colour to the principal zone in the chromatogram obtained with the reference solution. The chromatogram also shows an intense orange-yellow zone near the solvent front and a yellow zone in the upper third (carotenoids).
TESTS
Foreign matter (2.8.2): maximum 1 per cent.
Loss on drying (2.2.32): maximum 10.0 per cent, determined on 1.000 g of the powdered drug (355) (2.9.12) by drying in an oven at 105 °C.
Total ash (2.4.16): maximum 7.0 per cent.
ASSAY
Test solution. In a round-bottomed flask, weigh 0.500 g of the freshly powdered drug (710) (2.9.12). Add a solution of 1.0 g of oxalic acid R in 50.0 mL of methanol R. Boil under a reflux condenser for 10 min, and cool in iced water until the temperature reaches 15-20 °C. Filter. Transfer 2.0 mL of the filtrate to a 50 mL conical flask. Add successively, with gentle shaking after each addition, 2.0 mL of dichlorophenolindophenol standard solution R and then, exactly 60 s later, 0.5 mL of a 100 g/L solution of thiourea R in ethanol (50 per cent V/V) R and 0.7 mL of dinitrophenylhydrazine-sulfuric acid solution R. Heat under a reflux condenser at 50 °C for 75 min, and place immediately in iced water for 5 min. Add dropwise 5.0 mL of a mixture of 12 mL of water R and 50 mL of sulfuric acid R, taking care to carry out the addition over a period of minimum 90 s and maximum 120 s while maintaining vigorous stirring in iced water. Allow to stand for 30 min at room temperature and measure the absorbance (2.2.25) at 520 nm using solution A as compensation liquid.
Solution A. Treat 2.0 mL of the filtrate obtained during the preparation of the test solution as described but adding the dinitrophenylhydrazine-sulfuric acid solution R just before the absorbance is measured.
Reference solution. Dissolve 40.0 mg of ascorbic acid R in a freshly prepared 20 g/L solution of oxalic acid R in methanol R and dilute to 100.0 mL with the same solvent. Dilute 5.0 mL of this solution to 100.0 mL with a freshly prepared 20 g/L solution of oxalic acid R in methanol R. Treat 2.0 mL of the solution as described above for the filtrate obtained during the preparation of the test solution. Measure the absorbance (2.2.25) at 520 nm using solution B as the compensation liquid.
Solution B. Treat 2.0 mL of the reference solution as described above for solution A.
Calculate the percentage content of ascorbic acid from the following expression:
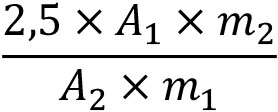
A1 = absorbance of the test solution;
A2 = absorbance of the reference solution;
m1 = mass of the substance to be examined, in grams;
m2 = mass of ascorbic acid used, in grams.