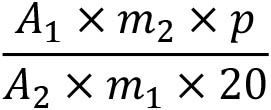Капли датского короля
Капли датского короля.
Российская военная фармакопея, 1913 год.


Наше предприятие осуществляет заготовку, сушку и реализацию пряно-ароматического и лекарственного…
Европейская Фармакопея издание 7.0 часть 1 2010 год (Ph. Eur. 7.0) стр. 1196-1197. Листья крапивы
01/2011:1897
КРАПИВЫ ЛИСТ
Urticae folium
ОПРЕДЕЛЕНИЕ
Целые или измельчённые высушенные листья вида Urtica dioica L., Urtica urens L. или смесь этих двух видов.
Содержание: минимум 0,3% суммы кофеоилмаловой кислоты и хлорогеновой кислоты в пересчёте хлорогенувую кислоту (C16H18O9; Mr 354.3) (сухое сырьё).
ИДЕНТИФИКАЦИЯ
A. Листья тёмно-зелёные, тёмно серовато-зелёные или коричневато-зелёные с верхней стороны, более бледные с нижней; разбросанные стрекательные волоски встречаются на обеих поверхностях, а так е малые кроющие трихомы, которые более многочисленны по краям и на жилках на нижней поверхности. Пластинка сильносморщенная, яйцевидная или продолговатая, до 100 мм длиной и 50 мм шириной, с крупно-пильчатым краем и сердцевидным или округлым основанием. Жилкование сетчатое и отчетливо видное на нижней поверхности. Черешок зеленый или буровато-зеленый, округлый или сплюснутый, около 1 мм шириной, продольнобороздчатый и скрученный он покрыт жгучими волосками и кроющими трихомами.
B. Растереть в порошок (355) (2.9.12). Порошок зелёного или серовато-зелёного цвета. Изучить под микроскопом, используя раствор хлоралгидрата Р. Порошок демонстрирует следующие диагностические признаки (рисунок 1897.-1): фрагменты одноклеточных жгучих волосков [A, B, C] до 2 мм длиной, состоящих изудлинённой конусообразной клетки со слегка утолщённым кончиком, который легко отламывается, выходящих из приподнятого многоклеточного основания [Ca]; небольшие железистые трихомы [F] (35-65 мкм), с одно- или двуклеточной ножкой и дву- или четырёхклеточной головкой, отдельно [Fa], или на фрагментах эпидермиса [Fb] ; фрагменты верхнего эпидермиса листьев, вид сверху [G] или в поперечном сечении [D], демонстрирующие слегка извилистые клетки [Da, Gc], одноклеточные, ровные или слегка изогнутые кроющие трихомы, расширенные у основания, до 700 мкм длинной [Dc, Ga] и множественные крупные цистолиты [Db, Ea, Gb], полые или содержащие плотные, зернистые массы карбоната кальция; палисадная паренхима, вид сверху [E], с округлыми клетками [Eb] окружающие цистолиты (Ea), или в поперечном сечении [Dd] ; фрагменты нижнего эпидермиса листьев демонстрируют клетки с извилистыми или волнистыми стенками [H], аномоцитные [Ha] или анизоцитные устьица [Hb] (2.8.3) сопровождающиеся губчатым мезофиллом, вид сверху [Hc] и в поперечном сечении [De] содержащие небольшие скопления кристаллов оксалата кальция, вид сверху [Hd] и в поперечном сечении [Df] ; случайные небольшие группы сосудов, в сопровождении паренхимы, содержащие группы кристаллов оксалата кальция [J].
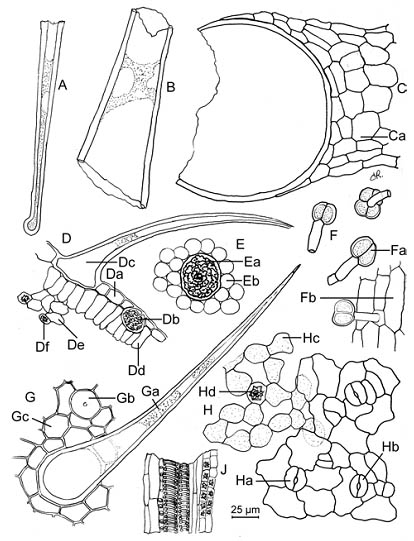
Figure 1897.-1.- Иллюстрация к идентификационному испытанию В порошка листьев крапивы.
C. Тонкослойная хроматография (2.2.27).
Испытуемый раствор. К 1 г растёртого в порошок сырья (355) (2.9.12) добавить 10 мл метанола Р. Прокипятить с обратным холодильником в течение 15 минут. Охладитьиотфильтровать. Выпарить досуха под вакуумом при 40 °C. Растворить остаток в 2 мл метанола Р.
Раствор сравнения. Растворить 1 мг скополетина Р и 2 мг хлорогеновой кислоты Р в 20 мл метанола Р.
Пластинка: силикагельная пластинка для ТСХ Р (5-40 мкм) [ или силикагельная пластинка для ТСХ Р (2-10 мкм)].
Подвижная фаза: безводная муравьиная кислота Р, метанол Р, вода Р, этилацетат Р (2.5:4:4:50 об/об/об/об).
Объём пробы: 10 мкл [или 4 мкл] в виде полос 10 мм [или 8 мм].
Фронт подвижной фазы: не мене 8 см [или 6 см].
Высушивание: на воздухе.
Обнаружение: нагреть до 100 °C в течение 5 минут; обрызгать ещё тёплую пластинку 10 г/л раствором аминоэтиловым эфиром дифенилборной кислоты Р в метаноле Р; исследовать в ультрафиолетовом свете при длине волны 365 нм.
Результаты : смотри ниже последовательность пятен на хроматограммах испытуемого раствора и раствора сравнения. Кроме того, другие тусклые голубые или жёлтые флуоресцентые пятна могут присутствовать в нижней половине хроматограммы испытуемого раствора.
|
Верх пластинки |
|
|
2 красных пятна |
|
Скополетин: интенсивное голубое флуоресцентное пятно |
|
|
|
|
|
__________________________________ |
__________________________________ |
|
__________________________________ |
__________________________________ |
|
|
|
|
|
|
|
Раствор сравнения |
Испытуемый раствор |
ИСПЫТАНИЯ
Посторонние вещества (2.8.2): максимум 5 % стеблей и максимум 5% других веществ (включая соцветия).
Потери при высушивании (2.2.32): максимум 12,0%, определять на 1,000 г измельчённого сырья (355) (2.9.12) высушиванием в сушильном шкафу при 105 °Cв течение 2 часов.
Общая зола (2.4.16): максимум 20,0%.
Зола, нерастворимая в хлороводородной кислоте (2.8.1): максимум 4,0%.
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Жидкостная хроматография (2.2.29).
Испытуемый раствор. К 0,200 г измельчённого сырья (355) (2.9.12) добавить 25,0 мл 40-го об/об раствора метанола Р. Экстрагировать в течение 30 минут в ультразвуковой бане при 40 °Cи отфильтровать.
Раствор сравнения. Растворить 10,0 ФСО хлорогеновой кислотыв 100,0 мл 40-го об/об раствора метанола Р. Разбавить 5,0 мл этого раствора до 25,0 мл 40%-м об/об раствором метанола Р.
Предколонка :
— размер: l =4 mm, Ø = 4 mm;
— неподвижная фаза (сорбент): октадецилсилильный силикагельс концевыми реакционноспособными группами для хроматографии Р (5 мкм).
Колонка:
— размер: l = 0.125 m, Ø = 4 mm;
— неподвижная фаза (сорбент): октадецилсилильный силикагельс концевыми реакционноспособными группами для хроматографии Р (5 мкм).
— температура: 25 °C.
Подвижная фаза:
— подвижная фаза A: смешать 15 объёмов метанола Р и 85 объёмов воды Р, довести pH 2,0 разведённой фосфорной кислотой Р;
— подвижная фаза В: метанол Р.
|
Время (мин) |
Подвижная фаза А |
Подвижная фаза В |
|
0 ∙ 1 |
100 |
0 |
|
1 ∙ 25 |
100 → 85 |
0 → 15 |
|
25 ∙ 35 |
85 |
15 |
|
35 ∙ 36 |
85 → 0 |
15 → 100 |
Скорость потока: 1 мл/мин.
Детектирование : спектрофотометрическое при 330 нм.
Объём вводимой пробы : 20 мкл.
Относительное время удерживания относительно хлорогеновой кислоты (время удерживания = около 13 минут): кофеоилмаловой кислоты = около 2,2.
Рассчитать процентное содержание кофеоилмаловой кислоты и хлорогеновой кислоты, выраженное через хлорогеновую кислоту, используя следующее выражение:
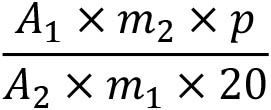
A1 = сумма площадей пиков кофеоилмаловой кислоты и хлорогеновой кислоты на хроматограмме испытуемого раствора;
A2 = площадь пика хлорогеновой кислоты на хроматограмме раствора сравнения;
m1 = масса образца сырья, использованная для приготовления испытуемого раствора, г;
m2 = масса ФСО хлорогеновой кислоты, использованная для приготовления раствора сравнения;
p = процентное содержание хлорогеновой кислоты в ФСО хлорогеновой кислоты.
01/2011:1897 NETTLE LEAF Urticae folium
DEFINITION
Whole or cut dried leaves of Urtica dioica L., Urtica urens L., or a mixture of the 2 species. Content : minimum 0.3 per cent for the sum of caffeoylmalic acid and chlorogenic acid, expressed as chlorogenic acid (C16H18O9; Mr 354.3) (dried drug).
IDENTIFICATION
A. The leaves are dark green, dark greyish-green or brownish-green on the upper surface, paler on the lower surface ; scattered stinging hairs occur on both surfaces, also small covering trichomes that are more numerous along the margins and on the veins on the lower surface. The lamina is strongly shrunken, ovate or oblong, up to 100 mm long and 50 mm wide, with a coarsely serrate margin and a cordate or rounded base. The venation is reticulate and distinctly prominent on the lower surface. The petiole is green or brownish-green, rounded or flattened, about 1 mm wide, longitudinally furrowed and twisted; it bears stinging hairs and covering trichomes.
B. Reduce to a powder (355) (2.9.12). The powder is green or greyish-green. Examine under a microscope using chloral hydrate solution R. The powder shows the following diagnostic characters (Figure 1897.-1): fragments of unicellular stinging hairs [A, B, C], up to 2 mm long, composed of an elongated tapering cell with a slightly swollen stinging tip that readily breaks off, arising from a raised, multicellular base [Ca] ; small glandular trichomes [F] (35-65 pm), with a uni- or bicellular stalk and a bi- or quadricellular head, isolated [Fa], or on fragments of the epidermis [Fb] ; fragments of the upper epidermis of the leaves in surface view [G] or in transverse section [D] showing slightly sinuous cells [Da, Gc], unicellular, straight or slightly curved covering trichomes, enlarged at the base, up to 700 pm long [Dc, Ga] and abundant large cystoliths [Db, Ea, Gb], empty or containing dense, granular masses of calcium carbonate; palisade parenchyma in surface view [E], with rounded cells [Eb] surrounding cystoliths (Ea), or in transverse section [Dd] ; fragments of lower epidermis of leaves showing sinuous or wavy-walled cells [H], anomocytic [Ha] or anisocytic stomata [Hb] (2.8.3) accompanied by spongy mesophyll in surface view [Hc] and in transverse section [De] containing small cluster crystals of calcium oxalate in surface view [Hd] and in transverse section [Df] ; occasional small groups of vessels, accompanied by parenchyma containing cluster crystals of calcium oxalate [J].
Figure 1897.-1.- Illustration for identification test B of powdered herbal drug of nettle leaf
C. Thin-layer chromatography (2.2.27).
Test solution . To 1 g of the powdered drug (355) (2.9.12) add 10 mL of methanol R. Boil under a reflux condenser for 15 min. Cool and filter. Evaporate to dryness in vacuo at 40 °C. Dissolve the residue in 2 mL of methanol R. Reference solution. Dissolve 1 mg of scopoletin R and 2 mg of chlorogenic acid R in 20 mL of methanol R.
Plate : TLC silica gel plate R (5-40 pm) [or TLC silica gel plate R (2-10 pm)].
Mobile phase : anhydrous formic acid R, methanol R, water R, ethyl acetate R (2.5:4:4:50 V/V/V/V).
Application :10 pL [or 4 pL] as bands of 10 mm [or 8 mm].
Development : over a path of 8 cm [or 6 cm].
Drying : in air.
Detection : heat at 100 °C for 5 min; spray the still-warm plate with a 10 g/L solution of diphenylboric acid aminoethyl ester R in methanol R; examine in ultraviolet light at 365 nm.
Results : see below the sequence of zones present in the chromatograms obtained with the reference solution and the test solution. Furthermore, other faint blue or yellow fluorescent zones may be present in the lower half of the chromatogram obtained with the test solution.
Верх пластинки
2 red zones
__________________________________
__________________________________
_________________________________
Chlorogenic acid: a blue fluorescent zone A blue fluorescent zone (chlorogenic acid)
A brownish-yellow zone
Reference solution
TESTS
Foreign matter (2.8.2): maximum 5 per cent of stems and maximum 5 per cent of other foreign matter (including inflorescences). Loss on drying (2.2.32): maximum 12.0 per cent, determined on 1.000 g of the powdered drug (355) (2.9.12) by drying in an oven at 105 °C for 2 h. Total ash (2.4.16): maximum 20.0 per cent. Ash insoluble in hydrochloric acid (2.8.1): maximum 4.0 per cent.
ASSAY Liquid chromatography (2.2.29). Test solution . To 0.200 g of the powdered drug (355) (2.9.12) add 25.0 mL of a 40 per cent V/V solution of methanol R. Extract for 30 min in an ultrasonic bath at 40 °C and filter. Reference solution . Dissolve 10.0 mg of chlorogenic acid CRS in 100.0 mL of a 40 per cent V/V solution of methanol R. Dilute 5.0 mL of this solution to 25.0 mL with a 40 per cent V/V solution of methanol R. Precolumn : — size: l =4 mm, Ø = 4 mm; — stationary phase: end-capped octadecylsilyl silica gel for chromatography R (5 pm).
Column : — size: l = 0.125 m, Ø = 4 mm; — stationary phase: end-capped octadecylsilyl silica gel for chromatography R (5 pm); — temperature: 25 °C.
Mobile phase : — mobile phase A: mix 15 volumes of methanol R and 85 volumes of water R and adjust to pH 2.0 with dilute phosphoric acid R; — mobile phase B: methanol R
Time (min) Mobile phase A (per cent V/V) Mobile phase B (per cent V/V) 0 ∙ 1 100 0 1 ∙ 25 100 → 85 0 → 15 25 ∙ 35 85 15 35 ∙ 36 85 → 0 15 → 100
Flow rate : 1 mL/min. Detection : spectrophotometer at 330 nm. Injection : 20 μL. Relative retention with reference to chlorogenic acid (retention time = about 13 min): caffeoylmalic acid = about 2.2. Calculate the percentage content of caffeoylmalic acid and chlorogenic acid, expressed as chlorogenic acid, using the following expression: A1 = sum of the areas of the peaks due to caffeoylmalic acid and chlorogenic acid in the chromatogram obtained with the test solution; A2 = area of the peak due to chlorogenic acid in the chromatogram obtained with the reference solution; m1 = mass of the drug to be examined used to prepare the test solution, in grams; m2 = mass of chlorogenic acid CRS used to prepare the reference solution, in grams; p = percentage content of chlorogenic acid in chlorogenic acid CRS.
Scopoletin: an intense blue fluorescent zone
A blue fluorescent zone (scopoletin)
A blue fluorescent zone
__________________________________
Test solution