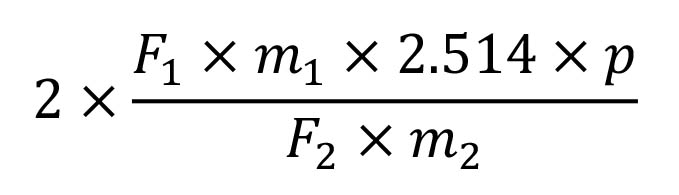Капли датского короля
Капли датского короля.
Российская военная фармакопея, 1913 год.


Наше предприятие осуществляет заготовку, сушку и реализацию пряно-ароматического и лекарственного…
Европейская Фармакопея издание 7.0 часть 1 2010 год (Ph. Eur. 7.0) стр. 1138-1140. Гинкго лист
01/2011:1828
Гинкго лист
Ginkgonisfolium
ОПРЕДЕЛЕНИЕ
Целые или измельчённые высушенные листья Ginkgo biloba L.
Содержание: не менее 0,5% флавоноидов в пересчёте на флавоновые гликозиды (Mr 757) (высушенное сырьё).
ИДЕНТИФИКАЦИЯ
A. Лист сероватый или желтовато-серый или желтовато-коричневый. Верхняя поверхность слегка темнее нижней. Чепешки около 4-9 см длинной. Пластинка около 4-10 см шириной, в форме веера, обычно двудольная или иногда нераздельная. Обе поверхности гладкие, жилкование дихотомическое, жилки расходятся радиально от основания; они одинаково видны и обеих сторон. Дистальный край рассечен неравномерно и до разной степени, он бессистемно лопастной или выемчатый. Боковой край цельный и суживающийся к основанию.
B. Измельчить в порошок (355) (2.9.12). Порошок сероватый или желтовато-серый или желтовато-коричневый. Изучить под микроскопом, используя раствор хлоралгидрата Р. У порошка следующие диагностические признаки (Рисунок 1828.-1): фрагменты пластинки разной формы [A, B, D, E], с верхним эпидермисом вид поверхности (D), поперечый срез (E), который состоит из продолговатых клеток с неравномерно волнистыми стенками [Da], часто в сопровождении палисадной паренхимы [Db], и нижним эпидермисом вид поверхности (A) поперечный срез (B), который состоит из мелких клеток с мелкоморщинистой кутикулой, а каждая клетка имеет короткий бугорок [Aa] и устьица [Ab] размером около 60 мкм, крупные, глубоко погружённый с 6-8 побочными (сопровождающими) клетками; фрагменты сосудистой ткани черешка и жилок [C] с ксилемой [Ca] и паренхимой, некоторые клетки содержат многочисленные группы кристаллов оксалата кальция различных размеров [Cb].
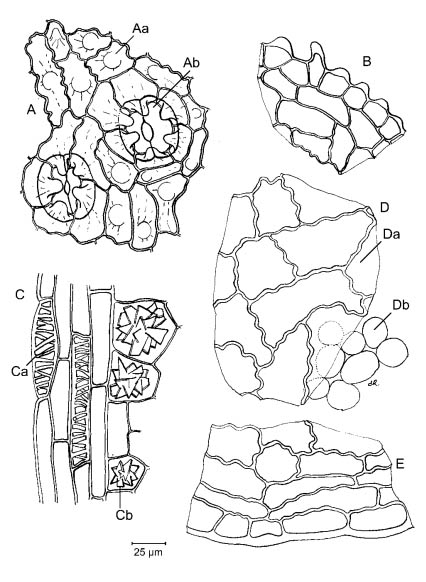
Рисунок 1828. -1. — Иллюстрация к идентификационному тесту Bпорошка листа гинкго
C. Тонкослойная хрометография (2.2.27).
Испытуемый раствор. К 2,0 г измельчённого сырья (710) (2.9.12) добавить 10 мл метанола Р. Нагреть на водяной бане при 65 °Cв течение 10 минут. Интенсивно встряхнуть. Дать остыть до комнатной температуры и отфильтровать.
Растор сравнения. Растворить 1,0 мг хлорогеновой килоты Р и 3,0 мг рутина Р в 20 мл метанола Р.
Платинка: ТСХ силикагельная пластинка Р.
Подвижная фаза: безводная муравьиная килота Р, ледяная уксусная кислота Р, вода Р, этилацетат Р (7,5:7,5:17,5:67,5 V/V/V/V).
Объём пробы: 20 мкл в виде полос.
Фронт подвижной фазы: не менее 17 см.
Высушивание: при 100-105 °C.
Проявление: обрызгать тёплую пластинку раствором 10 г/л дифенилборной кислоты аминоэтилового эфира Р в метаноле Р, затем опрыскать раствором 50 г/л макрогола 400 Р в метаноле Р; дать высохнуть на воздухе в течение 30 минут и изучить в ультрафиолетовом свете при длине волны 365 нм.
Результаты: смотри ниже последовательность пятен на полученных хроматограммах раствора сравнения и испытуемого раствора. Помимо этого на хроматограмме испытуемого раствора могут присутствовать другие слабофлуоресцирующие пятна.
| Верх пластинки | |
|
Желтовато-коричневое флуоресцентное пятно |
|
|
Зелёное флуоресцентное пятно |
|
|
2 желтовато-коричневых флуоресцентных пятна |
|
Хлорогеновая кислота: светло-голубое флуоресцентное пятно |
|
Зелёное флуоресцентное пятно |
|
Рутин: желтовато-коричневое флуоресцентное пятно |
2 желтовато-коричневых флуоресцентных пятна |
|
Зелёное флуоресцентное пятно |
|
|
|
|
| Раствор сравнения | Испытуемый раствор |
ИСПЫТАНИЯ
Посторонние вещества (2.8.2): максимум 5% стеблей и 2% других посторонних веществ.
Потеря привысушивании (2.2.32): максимум 11,0%, определяют на 1,000 г измельчённого сырья (355) (2.9.12) высушиванием в сушильном шкафу при 105 °Cв течение 2 часов.
Общая зола (2.4.16): максимум 11,0%.
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Флавоноиды. Жидкостная хроматография (2.2.29).
Испытуемый раствор. Нагреть 2,500 г измельчённого сырья (710) (2.9.12) в 50 мл 60%-го об/об раствора ацетона Р с обратным холодильником в течение 30 минут. Отфильтровать и собрать фильтрат. Экстрагировать остаток в второй раз тем же образом, используя 40 мл 60%-го об/об раствора ацетона Р и отфильтровать. Собрать фильтраты и разбавить до 100,0 мл 605-м об/об раствором ацетона Р. Выпарить 50,0 мл раствора для удаления ацетона и перенсте в 50,0 миллилитровую виалу, споласкивая 30 миллилитрами метанола Р. Добавить 4,4 мл соляной кислоты Р1, разбавить до 50,0 миллилитрами воды Р и отцентрифугировать.
Поместить 10 мл надосадочной жидкости в 10 миллилитровую виалу из коричневого стекла. Закрыть резиновой пробкой и алюминиевой крышкой и нагревать на водяной бане в течение 25 минут. Дать остыть до комнатной температуры.
Раствор сравнения. Растворить 10,0 мг квертицина дигидрата Р в 20 мл метанола Р. Добавить 15,0 мл разведённой соляной кислоты Р и 5 мл воды Р и развести до 50,0 мл метанола Р.
Колонка:
- размер: l = 0,125 м, Ø = 4 mm;
- неподвижная фаза: октадецилсилильный силикагель для хроматографии Р (5 мкм);
- температура: 25 °C.
Подвижная фаза:
- подвижная фаза A: 0,3 г/л раствор фосфорной кислоты Р доведённой до pH 2,0;
- подвижная фаза B: метанол Р;
|
Время (мин) |
Подвижная фаза A (% об/об) |
Подвижная фаза B (% об/об) |
| 0∙1 | 60 | 40 |
| 1 ∙ 20 | 60 → 45 | 40 → 55 |
| 20 ∙ 21 | 45 → 0 | 55 → 100 |
| 21 ∙ 25 | 0 | 100 |
Скорость потока: 1,0 мл/мин.
Детектирование: спектрофотометрическое при 370 нм.
Объём вводимой пробы: 10 мкл.
Время удерживания относительно квертецина (время удерживания квертецина = около 12,5 минут): кемпферол = около 1,4; изорамнетин = около 1,5.
Пригодность хроматографической системы:
— разрешение: минимум 1,5 между пиками кепферола и изорамнетина.
Не брать в расчёт пики на хроматограмме испытуемого раствора, выходящие до пика квертицина или после пика изорамнетина.
Рассчитать процентное содержание флавоноидов, выраженное через флавоновые гликозиды, используя следующее выражение:
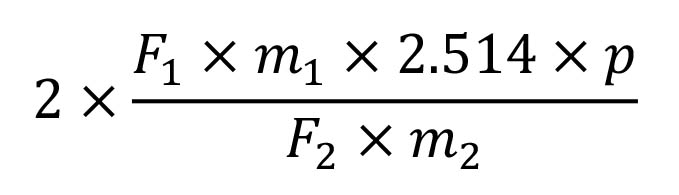
F1 = сумма площадей всех учитываемых пиков на хроматограмме испытуемого раствора;
F2 = площадь пика, соответствующего квертецину на хроматограмме раствора сравнения;
m1 = масса квертецина, взятого для приготовления раствора сравнения, г;
m2 = масса образца листьев, взятых для приготовления испытуемого раствора, г;
p = процентное содержание безводного квертецина в квертецина дигидрате Р.
GINKGO LEAF Ginkgonis folium DEFINITION Whole or fragmented, dried leaf of Ginkgo biloba L. Content: not less than 0.5 per cent of flavonoids, expressed as flavone glycosides (Mr 757) (dried drug). IDENTIFICATION A. The leaf is greyish or yellowish-green or yellowish-brown. The upper surface is slightly darker than the lower surface. The petioles are about 4-9 cm long. The lamina is about 4-10 cm wide, fan-shaped, usually bilobate or sometimes undivided. Both surfaces are smooth, and the venation dichotomous, the veins appearing to radiate from the base; they are equally prominent on both surfaces. The distal margin is incised, irregularly and to different degrees, and irregularly lobate or emarginate. The lateral margins are entire and taper towards the base. B. Reduce to a powder (355) (2.9.12). The powder is greyish or yellowish-green or yellowish-brown. Examine under a microscope using chloral hydrate solution R. The powder shows the following diagnostic characters (Figure 1828.-1): irregularly-shaped fragments of the lamina [A, B, D, E], with the upper epidermis, in surface view (D) and transverse section (E), consisting of elongated cells with irregularly sinuous walls [Da], often accompanied by palisade parenchyma [Db], and the lower epidermis, in surface view (A) and transverse section (B), consisting of small cells, with a finely striated cuticle and each cell shortly papillose [Aa], and stomata [Ab] about 60 pm, wide, deeply sunken with 6-8 subsidiary cells; fragments of vascular tissue from the petiole and veins [C] with xylem [Ca] and parenchyma, some cells containing abundant cluster crystals of calcium oxalate of various sizes [Cb]. Figure 1828.-1.- Illustration for identification test B of powdered herbal drug of ginkgo leaf C. Thin-layer chromatography (2.2.27). Test solution. To 2.0 g of the powdered drug (710) (2.9.12) add 10 mL of methanol R. Heat in a water-bath at 65 °C for 10 min. Shake frequently. Allow to cool to room temperature and filter. Reference solution. Dissolve 1.0 mg of chlorogenic acid R and 3.0 mg of rutin R in 20 mL of methanol R. Plate: TLC silica gel plate R.
Mobile phase: anhydrous formic acid R, glacial acetic acid R, water R, ethyl acetate R (7.5:7.5:17.5:67.5 V/V/V/V). Application: 20 μL as bands. Development: over a path of 17 cm. Drying: at 100-105 °C. Detection: spray the warm plate with a 10 g/L solution of diphenylboric acid aminoethyl ester R in methanol R, then with the same volume of a 50 g/L solution of macrogol 400 R in methanol R; allow to dry in air for about 30 min and examine in ultraviolet light at 365 nm. Results: see below the sequence of zones present in the chromatograms obtained with the reference solution and the test solution. Furthermore, other weak fluorescent zones may be present in the chromatogram obtained with the test solution.
Foreign matter (2.8.2): maximum 5 per cent of stems and 2 per cent of other foreign matter. Loss on drying (2.2.32): maximum 11.0 per cent, determined on 1.000 g of the powdered drug (355) (2.9.12) by drying in an oven at 105 °C for 2 h. Total ash (2.4.16): maximum 11.0 per cent. Flavonoids. Liquid chromatography (2.2.29). Test solution. Heat 2.500 g of the powdered drug (710) (2.9.12) in 50 mL of a 60 per cent V/V solution of acetone R under a reflux condenser for 30 min. Filter and collect the filtrate. Extract the drug residue a 2nd time in the same manner, using 40 mL of a 60 per cent V/V solution of acetone R and filter. Collect the filtrates and dilute to 100.0 mL with a 60 per cent V/V solution of acetone R. Evaporate 50.0 mL of the solution to eliminate the acetone and transfer to a 50.0 mL vial, rinsing with 30 mL of methanol R. Add 4.4 mL of hydrochloric acid R1, dilute to 50.0 mL with water R and centrifuge. Place 10 mL of the supernatant in a 10 mL brown-glass vial. Close with a rubber seal and an aluminium cap and heat on a water-bath for 25 min. Allow to cool to room temperature. Reference solution. Dissolve 10.0 mg of quercetin dihydrate R in 20 mL of methanol R. Add 15.0 mL of dilute hydrochloric acid R and 5 mL of water R and dilute to 50.0 mL with methanol R. Column: — size: l = 0.125 m, Ø = 4 mm; — stationary phase: octadecylsilyl silica gel for chromatography R (5 μm); — temperature: 25 °C. Mobile phase: — mobile phase A: 0.3 g/L solution of phosphoric acid R adjusted to pH 2.0; — mobile phase B: methanol R; Time Detection: spectrophotometer at 370 nm. Injection: 10 μL. Relative retention with reference to quercetin (retention time = about 12.5 min): kaempferol = about 1.4; isorhamnetin = about 1.5. System suitability: — resolution: minimum 1.5 between the peaks due to kaempferol and isorhamnetin. Do not take into account peaks eluting before the quercetin peak or after the isorhamnetin peak in the chromatogram obtained with the test solution. Calculate the percentage content of flavonoids, expressed as flavone glycosides, using the following expression: F1 = sum of the areas of all the considered peaks in the chromatogram obtained with the test solution; F2 = area of the peak corresponding to quercetin in the chromatogram obtained with the reference solution; m1 = mass of quercetin used to prepare the reference solution, in grams; m2 = mass of the drug to be examined used to prepare the test solution, in grams; p = percentage content of anhydrous quercetin in quercetin dihydrate R.
01/2011:1828
Top of the plate
A yellowish-brown fluorescent zone
A green fluorescent zone
2 yellowish-brown fluorescent zones
Chlorogenic acid: a light blue fluorescent zone
An intense light blue fluorescent zone sometimes overlapped by a greenish-brown fluorescent zone
A green fluorescent zone
Rutin: a yellowish-brown fluorescent zone
2 yellowish-brown fluorescent zones
A green fluorescent zone
A yellowish-brown fluorescent zone
Reference solution
Test solution
TESTS
ASSAY
(min)Mobile phase A
(per cent V/V)Mobile phase B
(per cent V/V)
0∙1
60
40
1 ∙ 20
60 → 45
40 → 55
20 ∙ 21
45 → 0
55 → 100
21 ∙ 25
0
100
Flow rate: 1.0 mL/min.