
Капли датского короля
Капли датского короля.
Российская военная фармакопея, 1913 год.


Наше предприятие осуществляет заготовку, сушку и реализацию пряно-ароматического и лекарственного…
Европейская Фармакопея издание 6.0 часть 2 2008 год (Ph. Eur. 6.0)
стр. 1311-1312. Берёзы лист
01/2008:1174 исправлено 6.0
Берёзы лист
Betulae folium
ОПРЕДЕЛЕНИЕ
Целые или измельчённые высушенные листья BetulapendulaRoth и/или BetulapubescensEhrh., а также гибриды обоих видов.
Состав: минимум 15% флавоноидов, в пересчёте на геперозид (C21H20O12; М.м. 464.4) (в сухом сырье).
ИДЕНТИФИКАЦИЯ
Испытуемый раствор. К 1 г измельчённого сырья (355) (2.9.12) добавить 10 мл метанола Р. Нагревать на водяной бане при 60 °C 5 минут. Охладить и отфильтровать раствор.
Раствор сравнения. Растворить 1 мг кофейной кислоты Р и 1 мг хлорогеновой килоты Р, 2,5 мг гиперозида Р и 2,5 мг рутина Р в 10 мл метанола Р.
Пластинка: ТСХ силикагельная пластинка Р.
Подвижная фаза: безводная муравьиная кислота Р, вода Р, метилэтилкетон Р, этилацетат Р (10:10:30:50 об/об/об/об).
Нанесение: 10 мкл, в виде полос.
Фронт подвижной фазы: 10 см от линии старта.
Высушивание: в токе теплого воздуха.
Проявление: пластинку опрыскать раствором 10 г/л дифенилборной кислоты аминоэтилового эфира Р в метаноле Р; затем опрыскать раствором 50 г/л макрогола 400 Р в метаноле Р; дать подсохнуть на воздухе 30 мин и изучить в ультрафиолетовом свете при длине волны 365 нм.
Результаты: на полученной хроматограмме раствора сравнения 3 пятна в нижней половине: в порядке возрастания Rf сначала идёт желтовато-коричневое флуоресцентное пятно (рутин), светло-голубое пятно (хлорогеновая кислота) и желтовато-коричневое флуоресцентное пятно (гиперозид), а в верхней трети светло-голубое флуоресцентное пятно (кофейная кислота). На хроматограмме испытуемого раствора 3 пятна с положением и флюоресценцией соответствующими рутину, хлорогеновой кислоте и гиперозиду на хроматограмме раствора сравнения. Пятно рутина очень тусклое, а пятно гиперозида интенсивное. Также наблюдаются другие желтовато-коричневые слабо флуоресцирующие пятна между пятнами кофеиновой и хлорогеновой кислот на хроматограмме раствора сравнения. Возле фронта растворителя наблюдается красное флуоресцентное пятно хлорофилла. На хроматограмме раствора между этим пятном и пятном кофейной кислоты находится коричневато-жёлтое пятно кверцетина.
ИСПЫТАНИЯ
Посторонние вещества (2.8.2): максимум 3% частиц женских серёжек (шишковидных тирсов) и максимум 3% других посторонних веществ.
Потеря при высушивании (2.2.32): максимум 10,0%, определяют на 1,000 г растёртого в порошок сырья (355) высушиванием его в сушильном шкафу при 105 °C в течение 2 часов.
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Исходный раствор. Поместить в круглодонную колбу на 100 мл 0,200 г растёртого в порошок сырья (355) (2.9.12), 1 мл раствора 5г/л гексаметилентетрамина Р, 20 мл ацетона Р и 2 мл соляной кислоты Р1. Прокипятить смесь с обратным холодильником в течение 30 минут. Отфильтровать жидкость через ватный тампон в колбу на 100 мл. Поместить ватный фильтр к остаткам в круглодонной колбе и экстрагировать 2 порциями, каждая по 20 мл, ацетона Р, каждый раз кипятя с обратным хоолодильником в течение 10 минут. Дать остыть до комнатной температуры, отфильтровать сначала через ватный тампон, потом через бумажный фильтр в мерную колбу и довести до объёма 100,0 мл ацетоном Р, споласкивая колбу и фильтр. Взять 20,0 мл раствора в делительную воронку, добавить 20 мл воды Р и экстрагировать 1 порцией в 15 мл, а затем 3 порциями по 10 мл этилацетата Р. Объединить этилацетатные экстракты в делительную воронку, промыть 2 порциями по 50 мл воды Р, отфильтровать экстракт через безводный сульфат натрия Р в мерную колбу на 50 мл и довести до объёма 50 мл этилацетатом Р.
Испытуемый раствор. К 10,0 мл исходного раствора добавить 1 мл реактива алюминия хлорида Р и разбавить 25,0 миллилитрами 5%-го (об/об) раствора ледяной уксусной кислоты Р в метаноле Р.
Компенсационный раствор. Развести 10,0 мл исходного раствора до 25,0 мл 5%-м (об/об) раствором ледяной уксусной кислоты Р в метаноле Р.
Измерять оптическую плотность (2.2.25) испытуемого раствора по истечении 30 минут относительно компенсационного раствора при 425 нм.
Вычислить процентное содержание флавоноидов в пересчёте на гиперозид, используя следующее выражение: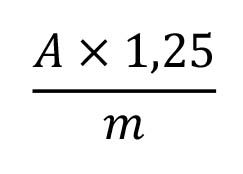
т.е. взяв удельную оптическую плотность гиперозида равной 500.
А = оптическая плотность при 425 нм,
m = масса испытуемого образца, г
01/2008:1174 corrected 6.0
BIRCH LEAF
Betulae folium
DEFINITION
Whole or fragmented dried leaves of Betula pendula Roth and/or Betula pubescens Ehrh. as well as hybrids of both species.
Content: minimum 1.5 per cent of flavonoids, expressed as hyperoside (C21H20O12; Mr 464.4) (dried drug).
IDENTIFICATION
A. The leaves of both species are dark green on the adaxial surface and lighter greenish-grey on the abaxial surface; they show a characteristic dense reticulate venation. The veins are light brown or almost white.
The leaves of Betula pendula are glabrous and show closely spaced glandular pits on both surfaces. The leaves of Betula pendula are 3-7 cm long and 2-5 cm wide; the petiole is long and the doubly dentate lamina is triangular or rhomboid and broadly cuneate or truncate at the base. The angle on each side is unrounded or slightly rounded, and the apex is long and acuminate.
The leaves of Betula pubescens show few glandular trichomes and are slightly pubescent on both surfaces. The abaxial surface shows small bundles of yellowish-grey trichomes at the branch points of the veins. The leaves of Betula pubescens are slightly smaller, oval or rhomboid and more rounded. They are more roughly and more regularly dentate. The apex is neither long nor acuminate.
B. Reduce to a powder (355) (2.9.12). The powder is greenish-grey. Examine under a microscope using chloral hydrate solution R. The powder shows the following diagnostic characters: numerous fragments of lamina with straight-walled epidermal cells and cells of the lower epidermis surrounding anomocytic stomata (2.8.3). Peltate large glands usually measuring 100-120 pm are found on the upper and lower epidermises. The mesophyll fragments contain calcium oxalate crystals. Fragments of radial vascular bundles and sclerenchyma fibres are accompanied by crystal sheaths. If Betula pubescens is present, the powder also contains unicellular covering trichomes with very thick walls, about 80-600 pm long, usually 100-200 pm.
C. Thin-layer chromatography (2.2.27).
Test solution. To 1 g of the powdered drug (355) (2.9.12) add 10 ml of methanol R. Heat in a water-bath at 60 °C for 5 min. Cool and filter the solution.
Reference solution. Dissolve 1 mg of caffeic acid R and 1 mg of chlorogenic acid R, 2.5 mg of hyperoside R and 2.5 mg of rutin R in 10 ml of methanol R.
Plate: TLC silica gel plate R.
Mobile phase: anhydrous formic acid R, water R, methyl ethyl ketone R, ethyl acetate R (10:10:30:50 V/V/V/V). Application: 10 μl, as bands.
Development: over a path of 10 cm.
Drying: in a current of warm air.
Detection: spray with a 10 g/l solution of diphenylboric acid aminoethyl ester R in methanol R; subsequently spray with a 50 g/l solution of macrogol 400 R in methanol R; allow to dry in air for 30 min and examine in ultraviolet light at 365 nm.
Results: the chromatogram obtained with the reference solution shows 3 zones in its lower half: in increasing order of Rf a yellowish-brown fluorescent zone (rutin), a light blue fluorescent zone (chlorogenic acid) and a yellowish-brown fluorescent zone (hyperoside), and in its upper third, a light blue fluorescent zone (caffeic acid). The chromatogram obtained with the test solution shows 3 zones similar in position and fluorescence to the zones due to rutin, chlorogenic acid and hyperoside in the chromatogram obtained with the reference solution. The zone due to rutin is very faint and the zone due to hyperoside is intense. It also shows other yellowish-brown faint fluorescence zones between the zones due to caffeic acid and chlorogenic acid in the chromatogram obtained with the reference solution. Near the solvent front, the red fluorescent zone due to chlorophylls is visible.
In the chromatogram obtained with the test solution, between this zone and the zone due to caffeic acid in the chromatogram obtained with the reference solution, there is a brownish-yellow zone due to quercetin.
TESTS
Foreign matter (2.8.2): maximum 3 per cent of fragments of female catkins and maximum 3 per cent of other foreign matter.
Loss on drying (2.2.32): maximum 10.0 per cent, determined on 1.000 g of powered drug (355) by drying in an oven at 105 °C for 2 h.
Total ash (2.4.16): maximum 5.0 per cent.
ASSAY
Stock solution. In a 100 ml round-bottomed flask introduce 0.200 g of the powdered drug (355) (2.9.12), 1 ml of a 5 g/l solution of hexamethylenetetramine R, 20 ml of acetone R and 2 ml of hydrochloric acid R1. Boil the mixture under a reflux condenser for 30 min. Filter the liquid through a plug of absorbent cotton in a 100 ml flask. Add the absorbent cotton to the residue in the round-bottomed flask and extract with 2 quantities, each of 20 ml, of acetone R, each time boiling under a reflux condenser for 10 min. Allow to cool to room temperature, filter the liquid through a plug of absorbent cotton then through a filter-paper in the volumetric flask, and dilute to 100.0 ml with acetone R by rinsing of the flask and filter. Introduce 20.0 ml of the solution into a separating funnel, add 20 ml of water R and extract the mixture with 1 quantity of 15 ml and then 3 quantities, each of 10 ml, of ethyl acetate R. Combine the ethyl acetate extracts in a separating funnel, rinse with 2 quantities, each of 50 ml, of water R, and filter the extract over 10 g of anhydrous sodium sulphate R into a 50 ml volumetric flask and dilute to 50.0 ml with ethyl acetate R.
Test solution. To 10.0 ml of the stock solution add 1 ml of aluminium chloride reagent R and dilute to 25.0 ml with a 5 per cent V/V solution of glacial acetic acid R in methanol R.
Compensation liquid. Dilute 10.0 ml of the stock solution to 25.0 ml with a 5 per cent V/V solution of glacial acetic acid R in methanol R.
Measure the absorbance (2.2.25) of the test solution after 30 min, by comparison with the compensation liquid at 425 nm.
Calculate the percentage content of flavonoids, expressed as hyperoside, using the following expression:
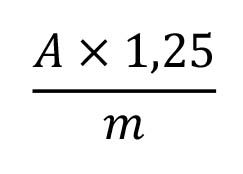
i.e. taking the specific absorbance of hyperoside to be 500.
A = absorbance at 425 nm,
m = mass of the substance to be examined, in grams.